No início dos anos oitenta do século passado, o Mundo despertou para uma das mais sérias ameaças ambientais do planeta: o fenómeno que ficou conhecido por “buraco do ozono”. De uma forma aparentemente repentina, os teores de ozono na estratosfera caíram para níveis perigosamente baixos, alarmando a comunidade científica da altura. Este era no entanto um fenómeno cíclico, maioritariamente sazonal e localizado: era observável todos os anos, no pólo sul, no princípio da Primavera naquelas latitudes, o que correspondia ao início do Outono no Hemisfério Norte.
A estratosfera é uma das cincos camadas em que é comum dividir a atmosfera, situando-se por cima da troposfera (a mais baixa) e por baixo da mesosfera e estendendo-se aproximadamente entre os 10 e os 50 km acima da superfície terrestre. Ao contrário do que sucede na troposfera, na estratosfera, a temperatura sobe com a altitude. É na estratosfera que a concentração de ozono é maior, sobretudo entre os 15 e os 35 km de altitude.
O ozono é um gás molecular, um dos alótropos do oxigénio, contendo três átomos de oxigénio na sua molécula (ao contrário do dioxigénio, o vulgar “oxigénio”, que respiramos todos os dias, que tem dois). As suas características estruturais permitem-lhe absorver radiação solar com comprimentos de onda compreendidos entre 220 e 320 nm (1 nanómetro – nm – corresponde a 0,000000001 metros), na região do ultravioleta. Esta costuma ser divida em três zonas espectrais, de consequências distintas para os organismos vivos que a recebem: UV-C, a mais letal (com comprimento de onda entre 100 e 280 nm); UV-B, ainda prejudicial (entre 280 e 320) e UV-A, mais inócua (entre 320 e 400 nm). Diga-se que, em geral, as radiações electromagnéticas são tão mais prejudiciais aos organismos vivos quanto menor for o seu comprimento de onda. O oxigénio existente nas regiões superiores da estratosfera e o ozono filtram a radiação da zona espectral UV-C, e o ozono sozinho filtra a grande maioria da radiação UV-B, protegendo os seres vivos à superfície do planeta. Daí a sua importância.
O alerta foi dado no princípio dos anos oitenta quando, um conjunto de observações (em 1982, 1984 e 1985) detectou que o teor de ozono na estratosfera sobre a Antártida diminuía em cerca de 70 % no período compreendido entre Setembro e Novembro, voltando a recuperar lentamente nos meses subsequentes, num processo regular e sazonal. Essa rarefacção da coluna de ozono preferencialmente numa zona localizada do globo depressa ganhou o nome de “buraco do ozono” e assim ainda é conhecido. Este buraco é, no entanto móvel: “abre” no princípio da Primavera do Hemisfério Sul e “fecha” no seu fim. A recuperação dos teores de ozono não era porém total, verificando-se uma delapidação progressiva dos níveis do gás de ano para ano. Naturalmente, uma diminuição acentuada da concentração de ozono estratosférico, implicaria necessariamente uma diminuição da eficácia com que a radiação UV era filtrada, com consequências nefastas para a vida na Terra. Mais tarde, foram detectados vestígios do fenómeno no pólo norte e até em algumas zonas afastadas dos pólos. As questões ambientais na segunda metade dos anos oitenta e primeira metade dos anos noventa foram dominadas pelos riscos do buraco do ozono, sobretudo enquanto não foi clara a razão científica para o fenómeno.
Mas rapidamente se encontraram os culpados: os clorofluorocarbonetos (CFC), principalmente. São compostos orgânicos, de estrutura semelhante aos hidrocarbonetos de cadeia carbonada curta, com átomos de flúor e cloro ligados aos de carbono (figura 1), sintéticos, produzidos e usados desde o princípio dos anos 30 do século XX. Eram sobretudo usados como refrigerantes (em frigoríficos ou aparelhos de ar condicionado), como agentes propulsores em frascos de spray e agentes de limpeza de material electrónico delicado, devidos às suas propriedades excepcionais: não inflamáveis, não-tóxicos, inertes e com óptimas características de evaporação/condensação. A sua inércia à superfície contrastava com uma insuspeitada actividade química em altitude. E a culpa é sobretudo do cloro.
Sob a acção da radiação ultravioleta, a ligação entre os átomos de cloro e a cadeia carbonada quebra-se, originando um átomo de cloro livre que por sua vez reage com a molécula de ozono. É importante dizer que, pela acção da luz, o ozono estratosférico se encontra permanentemente a formar-se a partir do oxigénio e a ser consumido originando este, num ciclo interminável de tal forma que, em média, o tempo de vida de cada molécula de ozono é apenas de cerca de meia hora. A existência de átomos de cloro ou de espécies químicas radicalares* envolvendo cloro (as chamadas espécies activas) provocam uma aceleração da destruição do ozono, desequilibrando os pratos da balança entre a sua produção e o seu consumo.
E porquê na Antártida? Sobretudo por causa das suas condições climatéricas excepcionais. O Inverno no pólo sul (entre Junho e Setembro) é particularmente frio, escuro, com pressões muito baixas e ventos fortes na estratosfera. Estas condições levam à condensação de água (que em parte solidifica) em torno de cristais constituídos sobretudo por ácido nítrico e ácido sulfúrico. Em torno da fase sólida dessas partículas, agrega-se água líquida. As partículas no seu conjunto formam as chamadas nuvens polares estratosféricas e constituem uma marca meteorológica profunda da região antártica, mantendo-se até meados da Primavera. Estas partículas (sobretudo a sua zona líquida absorvem cloro convertendo-o em cloro molecular (Cl2), espécie inactiva. O regresso da luz no início da Primavera promove a quebra das moléculas de Cl2, conduzindo à formação de grandes quantidades de átomos que cloro que atacam o ozono de uma forma excepcionalmente elevada. Este processo continua enquanto as partículas persistirem. Estas acabam por sucumbir à Primavera mais avançada, sendo o cloro convertido em formas inactivas, com o ozono a regressar aos poucos aos níveis quase normais. O investigador espanhol Mário Molina, divisou este mecanismo como explicação para o fenómeno da depleção de ozono na Antártida, tendo por isso recebido o Prémio Nobel da Química em 1995, em conjunto com o norte-americano F. Sherwood Rowland e o holandês Paul Crutzen.
Neste caso, os vários governos mundiais revelaram-se pró-activos no ataque ao problema, unindo-se em torno da necessidade urgente de proteger a vida na Terra. Na Convenção de Viena (1985) quase duas dezenas de países comprometeram-se a tomar as medidas prementes para proteger a saúde pública da ameaça, a começar em 1988; o protocolo de Montreal (1987) entraria em vigor em 1989 e era mais específico, obrigando os signatários a tomar medidas para redução de emissão de substâncias que empobrecem a camada de ozono e estabelecendo metas, posteriormente revistas em 1990 (Londres), 1992 (Copenhaga), Montreal (1997) e Pequim (1999). E a redução de emissão de CFC e compostos relacionados (HCFC – com hidrogénio; cloretos de alquilo e compostos contendo bromo) foi um facto e o sucesso desta iniciativa contrasta com as frustrantes tentativas de que a imposição de metas para redução de emissão de gases de efeito de estufa inclua o país mais poderoso do Mundo.
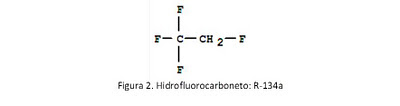
Porém, as razões económicas, que se percebe que estão na base das dificuldades de implementação do Protocolo de Quito, contribuíram ironicamente para o sucesso do Protocolo de Montreal. A substituição dos CFC foi também uma oportunidade de negócio, bem aproveitada pelo gigante químico americano Du Pont, líder em compostos fluorados desde os anos 20-30 do século XX. Os hidrofluorocarbonetos (hidrocarbonetos apenas com hidrogénio e flúor ligados à cadeia carbonada e sem cloro) constituem a família de substâncias que substituiu os CFC com maior sucesso (figura 2).
A redução de emissão de compostos que contribuem para o empobrecimento da camada de ozono foi abrupta a partir de meados dos anos noventa e os sinais de recuperação dos teores de ozono na estratosfera não se fizeram esperar. O problema é que o tempo de vida de um CFC na atmosfera é de algumas dezenas de anos. Prevê-se que por volta de 2050 os teores de ozono estratosférico voltem aos níveis de 1980. Com paciência, esta é uma luta que vamos vencer.
*Radical é uma espécie química com electrões desemparelhados e por isso muito reactiva.
Por
Luís Martins*
* Prof. Dep. Química da ECTUE e Centro de Química de Évora (CQE)


Sem comentários:
Enviar um comentário